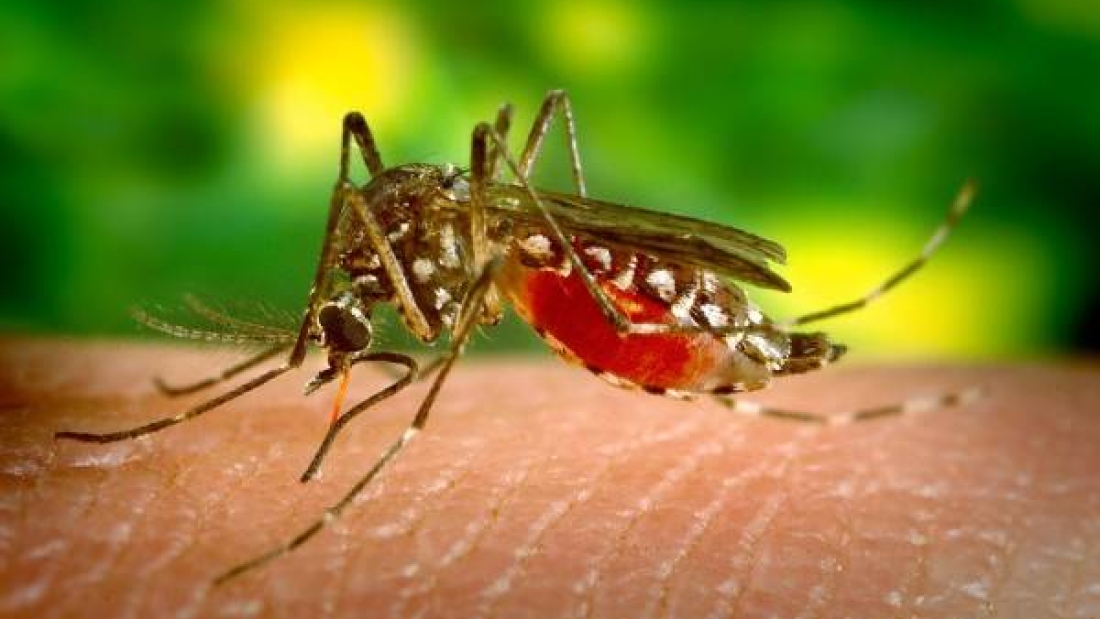
Investigadores describen el primer ensayo fuera del laboratorio de un enfoque para combatir la malaria con modificación genética. El estudio muestra que un hongo natural modificado para administrar una toxina a los mosquitos redujo de forma segura las poblaciones de mosquitos en más de un 99% en un entorno de pueblo simulado, cerrado por una pantalla, en Burkina Faso, África Occidental.
Según la Organización Mundial de la Salud, la malaria afecta a cientos de millones de personas en todo el mundo, matando a más de 400,000 al año. Décadas de uso de insecticidas no han logrado controlar los mosquitos que transportan el parásito de la malaria y han dado lugar a una resistencia a los insecticidas entre muchas cepas de mosquitos. En respuesta, los científicos comenzaron a modificar genéticamente los mosquitos y otros organismos que pueden ayudar a erradicarlos. Hasta ahora, ninguno de estos enfoques mediante transgenia había superado las pruebas de laboratorio.
[Recomendado: La edición genética elimina a los mosquitos transmisores de malaria]En un nuevo artículo de investigación publicado en la edición del 31 de mayo de 2019 de la revista Science, un equipo de científicos de la Universidad de Maryland y Burkina Faso describió el primer ensayo fuera del laboratorio de un enfoque mediante transgenia para combatir la malaria. El estudio demostró que un hongo natural modificado para administrar una toxina a los mosquitos redujo de forma segura las poblaciones de mosquitos en más de un 99% en un entorno de pueblo simulado, cerrado por una pantalla, en Burkina Faso, África Occidental.
[Recomendado: Brasil desarrolla mosquitos transgénicos «estériles» para erradicar el dengue, fiebre amarilla y otras enfermedades]«Ningún control transgénico de la malaria ha llegado tan lejos en el camino hacia las pruebas de campo reales», dijo Brian Lovett, un estudiante graduado en el Departamento de Entomología de la UMD y autor principal del artículo. «Este artículo marca un gran paso y sienta un precedente para que este y otros métodos transgénicos avancen».
«Demostramos que la eficacia de los hongos transgénicos es mucho mejor que el tipo convencional que justifica el desarrollo continuo», dijo Raymond St. Leger, un distinguido profesor universitario de entomología en la UMD y coautor del estudio.
[Recomendado: 10 formas en que la edición genética revolucionará la ciencia ambiental y la biorremediación]El hongo es un patógeno natural que infecta insectos en la naturaleza y los mata lentamente. Se ha utilizado para controlar diversas plagas durante siglos. Los científicos utilizaron una cepa del hongo que es específica para los mosquitos y la modificaron para producir una toxina que mata a los mosquitos más rápidamente de lo que pueden reproducirse. Este hongo transgénico causó que las poblaciones de mosquitos en su sitio de prueba colapsaran a niveles insostenibles dentro de dos generaciones.
«Se puede pensar que el hongo es una aguja hipodérmica que usamos para administrar una potente toxina específica para insectos en el mosquito», dijo St. Leger.
La toxina es un insecticida llamado «Hybrid». Se deriva del veneno de la araña de tela de embudo de las Montañas Azules de Australia y ha sido aprobado por la Agencia de Protección Ambiental (EPA) para su aplicación directamente en cultivos para controlar plagas de insectos agrícolas.
«La simple aplicación de los hongos transgénicos a una lámina que colgamos en una pared en nuestra área de estudio provocó que las poblaciones de mosquitos colapsaran en 45 días», dijo Lovett. «Y es tan eficaz para matar mosquitos resistentes a los insecticidas como los no resistentes».

Lovett dijo que las pruebas de laboratorio sugieren que el hongo infectará la gama de mosquitos portadores de malaria. La abundancia de especies que transmiten la malaria ha obstaculizado los esfuerzos para controlar la enfermedad, porque no todas las especies responden a los mismos métodos de tratamiento.
Para modificar el hongo Metarhizium pingshaense de modo que produzca y distribuya Hybrid, el equipo de investigación de la Universidad de Maryland utilizó un método estándar que emplea una bacteria para transferir intencionalmente el ADN a los hongos. El ADN que los científicos diseñaron e introdujeron en los hongos proporcionó los planos para crear Hybrid junto con un interruptor de control que le dice al hongo cuándo debe hacer la toxina.
El interruptor de control es una copia del propio código de ADN del hongo. Su función normal es decirle al hongo cuándo debe construirse una capa protectora alrededor de sí mismo para que pueda esconderse del sistema inmunológico de un insecto. Construir esa cáscara es costoso para el hongo, por lo que solo hace el esfuerzo cuando detecta el entorno adecuado, dentro del torrente sanguíneo de un mosquito.
Al combinar el código genético para ese interruptor con el código para hacer Hybrid, los científicos pudieron asegurarse de que su hongo modificado solo produce la toxina dentro del cuerpo de un mosquito. Ellos probaron su hongo modificado en otros insectos en Maryland y Burkina Faso, y encontraron que el hongo no era dañino para especies beneficiosas como las abejas.
«Estos hongos son muy selectivos», dijo St. Leger. «Saben dónde están a partir de las señales químicas y las formas de las características en el cuerpo de un insecto. La cepa con la que trabajamos es como los mosquitos. Cuando este hongo detecta que está en un mosquito, penetra en la cutícula del mosquito y entra al insecto; no causará problemas a otros insectos, por lo que es bastante seguro para especies beneficiosas como las abejas «.
Después de demostrar la seguridad de sus hongos genéticamente modificados en el laboratorio, Lovett y St. Leger trabajaron estrechamente con colegas científicos y autoridades gubernamentales en Burkina Faso para probarlo en un ambiente controlado que simulaba la naturaleza. En un área rural, endémica de la malaria en Burkina Faso, construyeron una estructura de aproximadamente 609 metros cuadrados, con mosquitero, que llamaron MosquitoSphere. En el interior, múltiples cámaras protegidas contenían chozas experimentales, plantas, pequeños charcos de cría de mosquitos y una fuente de alimento para los mosquitos.
En una serie de experimentos, los investigadores colgaron una sábana de algodón negro cubierta con aceite de sésamo en la pared de una choza en cada una de las tres cámaras. Una hoja recibió aceite mezclado con el hongo transgénico Metarhizium pingshaense, una recibió aceite con Metarhizium de tipo convencional y la otra recibió solo aceite de sésamo. Luego, liberaron 1,000 mosquitos machos adultos y 500 hembras adultas en cada cámara de MosquitoSphere para establecer poblaciones de reproductores. Luego, los investigadores contaron los mosquitos en cada cámara todos los días durante 45 días.
En la cámara que contiene la hoja tratada con el hongo transgénico, las poblaciones de mosquitos se desplomaron durante 45 días a solo 13 mosquitos adultos. Eso no es suficiente para que los machos creen un enjambre, que se requiere para que los mosquitos se reproduzcan. En comparación, los investigadores contaron 455 mosquitos en la cámara tratados con hongos de tipo convencional y 1.396 mosquitos en la cámara tratados con aceite de sésamo común después de 45 días. Hicieron este experimento varias veces con los mismos resultados dramáticos.
En experimentos similares en el laboratorio, los científicos también encontraron que las hembras infectadas con hongos transgénicos pusieron solo 26 huevos, solo tres de los cuales se convirtieron en adultos, mientras que las hembras no infectadas pusieron 139 huevos que dieron como resultado 74 adultos.
Según los investigadores, es sumamente importante que las comunidades locales empleen fácilmente nuevas tecnologías contra la malaria, como la probada en este estudio. Las sábanas de algodón negro y el aceite de sésamo son relativamente económicos y están disponibles a nivel local. La práctica tampoco requiere que las personas cambien su comportamiento, ya que el hongo se puede aplicar junto con los pesticidas que se usan comúnmente en la actualidad.

«Al seguir muy de cerca los protocolos de la EPA y la Organización Mundial de la Salud, trabajar con el gobierno central y local para cumplir con los criterios y trabajar con las comunidades locales para ganar aceptación, hemos roto una barrera», dijo Lovett. «Nuestros resultados tendrán amplias implicaciones para cualquier proyecto que proponga ampliar tecnologías nuevas, complejas y potencialmente controvertidas para la erradicación de la malaria».
Luego, el equipo internacional de científicos espera probar sus hongos transgénicos en una comunidad o aldea local. Hay muchos puntos de referencia regulatorios y sociales que deben cumplirse antes de implementar este nuevo método en un entorno abierto como un pueblo, pero los investigadores dijeron que este estudio ayuda a defender estos ensayos.