
Para lograr aplicaciones agrícolas mediante edición de genes, los mejoradores están enfrentando rasgos genéticos complejos, lidiando con incertidumbres regulatorias y refinando modelos in silico. Por suerte, estos desafíos están siendo abordados de manera práctica por investigadores con mentalidad comercial.
Genetic Engineering & Biotechnology News / 4 de abril, 2023.- Cuando usa la edición de genes CRISPR en plantas de cultivo, puede hacer «algunas cosas geniales», dice Timothy Kelliher, PhD, jefe de características de cultivos y descubrimiento de tecnología en Syngenta Seeds. Puede cambiar la estructura de los cromosomas, agregar grandes cantidades de material genético, mover genes, activar y desactivar genes y ajustar la expresión de genes. Y, sin embargo, admite Kelliher, la ineficiencia en llevar estas cosas geniales a los productos agrícolas comerciales “sigue siendo un problema”.
Entonces, ¿por qué la edición de genes CRISPR enfrenta desafíos comerciales? Hay varias respuestas. Uno de ellos, señala Kelliher, es la dificultad de modificar los rasgos de las plantas que dependen de múltiples genes. Escucharemos más sobre eso en un momento. Pero primero, citemos algunas otras complicaciones: dificultades específicas de la planta para realizar ediciones de ganancia de función, incertidumbres sobre las distinciones regulatorias entre plantas editadas genéticamente y OGMs (transgénicos), y limitaciones de modelado que impiden el diseño iterativo.
Afortunadamente, los desafíos de los cultivos editados por CRISPR están siendo abordados por investigadores con mentalidad comercial. Varios de ellos han contribuido con sus puntos de vista a este artículo. Comencemos con Kelliher.
No es tan simple
Incluso cuando se conocen características importantes de la planta, pueden plantear desafíos de edición de genes de enormes proporciones. A menudo, estos rasgos son complejos; es decir, involucran múltiples genes. «CRISPR es una gran herramienta en una caja de herramientas», señala Kelliher, «pero es raro encontrar formas fáciles de editar rasgos de plantas con grandes impactos».
Hay tantas frutas (y verduras) de bajo costo que solo necesitan modificaciones simples para modificar un rasgo. Una de las frutas maduras es la manzana «Arctic» que, según el discurso público, ha sido modificada en un gen que ayuda a reducir el pardeamiento/oxidación. En realidad, es un poco más complicado que eso. La manzana Artic ha sido modificada genéticamente con un transgén que produce ARN específicos que silencian la expresión de al menos cuatro genes de polifenol oxidasa (PPO). (En última instancia, la expresión de PPO, la enzima que causa el oscurecimiento, se reduce a través de la interferencia del ARN).
La resistencia al pardeamiento también se ha introducido en una papa, la Patata Innate. Aquí, al igual que con la manzana resistente al pardeamiento, los cambios que se han introducido son bastante simples, aunque tal vez no tan simples como sugieren los relatos populares. Para Innate, se reintrodujeron fragmentos de un solo gen PPO de papa en otra papa para activar una vía de interferencia de ARN. Además, se introdujo un transgén para utilizar la interferencia de ARN para reducir la expresión del gen de la asparagina sintetasa-1. Limitar la asparagina previene una reacción que ocurre en la cocción a alta temperatura y convierte la asparagina en acrilamida, que se sospecha que está asociada con el cáncer humano.
Modificaciones relativamente simples también han sido suficientes para mejorar la tolerancia a los herbicidas. A menudo, los herbicidas matan las plantas al atacar una enzima específica, pero la edición de genes puede cambiar un aminoácido en esa enzima para bloquear la unión de un químico que mata las plantas, haciendo que un cultivo sea resistente a los efectos perjudiciales del herbicida.
Sin embargo, en la mayoría de los casos, se desconocen los alelos óptimos para todos los genes involucrados en un rasgo complejo. Entonces, aunque existen herramientas para CRISPR, como Cas12, que permiten la multiplexación en una construcción con múltiples guías para diferentes objetivos genómicos, es un desafío biológico saber cómo editar cada gen involucrado en un rasgo y descubrir qué efecto tienen las diferentes ediciones en un rasgo cuando están todos juntos. Es más, dado que existe una gran cantidad de diversidad genética, redundancia de genes y variación estructural entre los cromosomas de las plantas, hay, dice Kelliher, muchos ejemplos en los que un gen o una edición funciona como se desea en una línea de cultivo pero tiene un efecto diferente en otra línea de cultivo.
[Recomendado: Edición genética: 7 formas en las que CRISPR está dando forma al futuro de los alimentos]
Menos es más
“La aplicación más simple de CRISPR en las plantas es hacer deleciones”, dice Michael Lassner, PhD, director científico de Amfora, que utiliza la edición de genes para mejorar la nutrición y la sostenibilidad de los cultivos de soya. «Si podemos eliminar motivos de unión reguladores negativos, aumenta el gen».
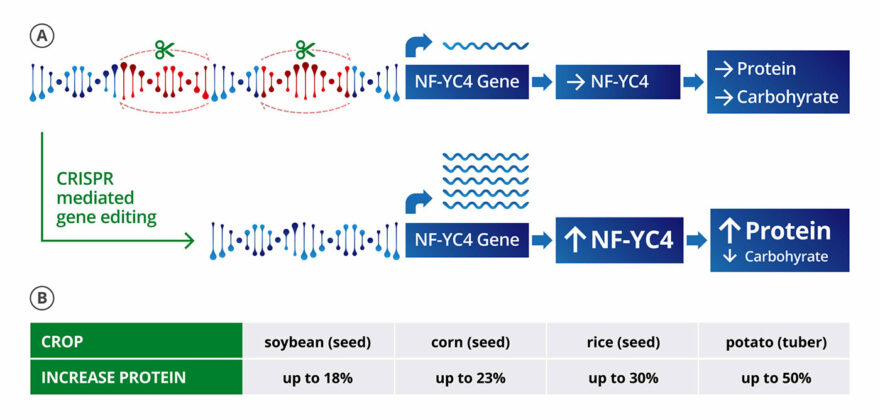
Con la estrategia de usar deleciones para regular al alza (sobreexpresar) los genes, Amfora está produciendo tipos de soya que tienen más proteína, lo cual es valioso para el uso principal de la soya: alimento para animales. Por ejemplo, para crear una soja con un 10 % de contenido de proteína potenciado a expensas de la producción de almidón, Amfora está eliminando ciertas regiones del promotor de NF-YC4, un miembro de una clase de reguladores de la transcripción que está altamente conservado en muchas especies de plantas. para aumentar la expresión del gen. (NF-YC4 actúa como un interruptor. Cuando está en «alto», favorece la producción de proteínas; cuando está en «bajo», la producción de carbohidratos. En ausencia de piezas específicas de ADN, NF-YC4 permanece en bajo).
Amfora está trabajando para llegar a un punto en el que las eliminaciones en las regiones promotoras se transmitan de generación en generación de manera estable, lo cual es fundamental para desarrollar un nuevo cultivo. Lassner señala que la edición de genes tiene poco o ningún impacto en el aceite (el otro producto económico de la soja) o en el rendimiento, que es lo que les importa a los agricultores en términos del costo de los bienes.
Amfora también está desarrollando un producto de soya que tiene un contenido de proteína «ultra alto», requiere menos energía para fabricarse y promete mejorar la funcionalidad de la harina de soya. “Una de las grandes fuentes de proteína de soya se llama concentrado de proteína de soya (más del 70% de proteína), explica Lassner. “Se convierte en proteína vegetal o de soya texturizada, que es un ingrediente clave en muchas de las carnes de origen vegetal. Y con los precios desorbitados de las materias primas hoy en día, vemos que hay una gran cantidad de espacio para que construyamos un negocio en el espacio de los ingredientes alimentarios mediante el uso de esta comida ultra rica en proteínas”.
En comparación con las eliminaciones, las inserciones son ediciones mucho más desafiantes. En las células animales, un alelo puede intercambiarse fácilmente con eficiencias del 50 al 70 %, donde la mayoría de las veces el alelo entra correctamente. En las plantas, la eficiencia suele ser inferior al 1%. El problema en las plantas es que la vía de reparación dirigida por homología, la vía que puede incorporar el ADN del donante, está menos disponible. En cambio, la reparación está dominada por la vía de unión de extremos no homólogos, que simplemente vuelve a unir los extremos sueltos del ADN roto.
Superar la ineficiencia de la reparación directa por homología en las plantas es una prioridad porque facilitaría la introducción de ediciones de ganancia de función, que son deseables porque prometen reducir las penalizaciones de rendimiento. Por ejemplo, podrían reducir la penalización del rendimiento asociada con los genes de resistencia a enfermedades en ciertas variedades de arroz. Cuando estos genes se cruzan en una nueva línea, pueden dar como resultado plantas que tienen una resistencia superior a las enfermedades pero rendimientos más bajos. Entonces, ¿qué pasaría si se pudiera ganar resistencia a las enfermedades sin penalizar el rendimiento?
«Si podemos hacer eso a través de la edición de genes, sería un nuevo alelo realmente poderoso que podríamos ofrecer», dice Lassner. “Ha habido algunas historias de éxito en esa área. Esas son cosas del siguiente nivel que requerirán algo de innovación tecnológica, así como cosas como el modelado estructural de proteínas para crear algo nuevo que no existe en la naturaleza y luego reemplazar el gen natural con esta cosa nueva que ha diseñado”.
[Recomendado: En 10 años, CRISPR transformó la medicina. ¿Puede ahora ayudarnos a enfrentar el cambio climático?]
Introducción de nuevos cultivos
Durante la última década, CoverCress ha trabajado para transformar el carraspique de campo (Thlaspi arvense), una maleza anual de invierno común, en un nuevo cultivo comercial rotativo a través de la mejoramiento sofisticado y la edición de genes. “Puedes usar las malas hierbas del borde de la carretera y simplemente cultivarlas, pero no van a crecer como un cultivo”, dice Ratan Chopra, PhD, vicepresidente de investigación de la compañía. “Tomamos una maleza y tratamos de domesticarla para ayudar a los agricultores a cultivarla”.
Usando CRISPR, CoverCress se está enfocando en características agronómicas, de composición y de aceite que podrían hacer que el carraspique sea un cultivo valioso. “Las características agronómicas son para que los agricultores crean que es un cultivo y no una maleza”, dice Chopra. “En términos de composición, siempre hay un coproducto de comida con semillas oleaginosas. Quiere la harina para mercados descendentes deseables, como piensos para animales o alimentos para humanos. Naturalmente, el carraspique tiene mucho aceite, pero para apuntar a la industria del diesel renovable y al campo de la aviación, necesitamos mejorar el perfil”.
CoverCress planea un lanzamiento a pequeña escala de su producto carraspique editado genéticamente este año. Pero la compañía no espera lanzar un alimento humano al mercado en el corto plazo. “Nos mantendremos alejados de los mercados de alimentos hasta que las agencias reguladoras descubran qué se debe hacer con la nueva cosecha y cómo la manejarán”, relata Chopra.
Ese no es el único obstáculo regulatorio que CoverCress está tratando de sortear. Algunos organismos reguladores han impuesto restricciones a la forma en que se desarrollan los cultivos editados genéticamente. Por ejemplo, dos genes no pueden ser atacados simultáneamente en los Estados Unidos sin una Revisión del estado regulatorio, que puede demorar entre uno y dos años, y que limita el uso de tecnologías CRISPR de multiplexación como Cas12 que pueden apuntar a múltiples loci genómicos con un constructo.
“No se pueden usar dos guías con la tecnología de edición para apuntar a dos genes simultáneamente”, explica Chopra. “En una construcción, solo puedes hacer un gen a la vez y luego cruzarlos entre sí. Entonces, eso es un cuello de botella. No es por la tecnología; se trata de la forma en que los reguladores piensan sobre los productos y cómo los creas”.
[Recomendado: CRISPR siembra “semillas de cambio” en biotecnología agrícola: mayor precisión y menor regulación]
OGMs vs. plantas editadas genéticamente
Toda esta innovación impulsada por CRISPR en biología agrícola depende de las decisiones regulatorias tomadas por los órganos rectores de todo el mundo. Y todos están conteniendo la respiración en cuanto a si estas plantas editadas genéticamente se clasificarán como organismos modificados genéticamente (OGMs o transgénicos).
Recientemente, el 7 de febrero de 2023, el tribunal supremo de Europa dijo que las leyes de la Unión Europea que restringen el uso de OGMs excluirían las técnicas de edición de genes de plantas in vitro, siempre que se usen de manera convencional y tengan un largo historial de seguridad. La decisión parece ser parte de una tendencia observada por Dan Jenkins, jefe de calidad y asuntos regulatorios y gubernamentales de Pairwise.
“Muchos gobiernos han tomado y se están preparando para llegar a la decisión de que muchas de las aplicaciones de esta tecnología y plantas no se consideren transgénicos”, dice. “Los gobiernos de América del Sur, América Central, Japón e India dicen que estas aplicaciones no son como los transgénicos. Diría que la forma en que están las regulaciones en este momento en todo el mundo es muy positiva y alentadora”.
También hay regulaciones para garantizar que los productos editados genéticamente sean seguros, y Pairwise indica que ha incorporado una gran cantidad de elementos normativos y de seguridad alimentaria para desarrollar un producto nutritivo, seguro, de alta calidad y fresco para los consumidores. Sin embargo, Jenkins cree que lo que debería importar es el producto final, no cómo se logró. Jenkins explica que las personas han estado seleccionando con éxito rasgos en las plantas a través de la reproducción durante cientos y miles de años.
Por ejemplo, las hojas de mostaza, la coliflor, las coles de Bruselas y el colinabo provienen de la selección de rasgos en el género de vegetales de las Brassicas. “Esas son cosas que se ven bastante diferentes, y la historia de la seguridad con esos cambios bastante sustanciales no debería dar a nadie demasiado motivo de preocupación, sino todo lo contrario”, sostiene Jenkins. “Ruby Red Grapefruit se creó a través de la mutagénesis, y eso es algo bastante saludable para comer. Creo que debería tratarse del producto, no del proceso”.
[Recomendado: Desarrollan nuevo sistema CRISPR 3.0 para activación genética múltiple de alta eficiencia en plantas]
Mejora de modelos in silico
Algunas empresas han creado modelos in silico que utilizan el machine learning para predecir combinaciones alélicas que, si se implementaran, tendrían una alta probabilidad de proporcionar un resultado beneficioso hacia un rasgo deseado. Estas empresas prueban plantas que poseen estas combinaciones y luego los resultados se transmiten a los modelos. Según Kelliher, la mayoría de los modelos disponibles actualmente identifican marcadores genéticos en los cromosomas que son importantes para rasgos como el rendimiento.
Los modelos en realidad no reconocen qué genes están involucrados. Por ejemplo, los modelos podrían decir que si se asegura de que un marcador genómico beneficioso en una ubicación cromosómica esté acompañado por un marcador similar en otra ubicación cromosómica, aumentará sus posibilidades de obtener un rendimiento aún mejor. Los modelos que utilizan únicamente marcadores genómicos satisfacen a los mejoradores, que no necesitan saber qué genes están realmente implicados. Sin embargo, tales modelos son inadecuados para los desarrolladores interesados en la edición del genoma. Estos desarrolladores necesitan saber qué genes y vías están implicados.
Kelliher dice que lo que el campo de la biotecnología agrícola necesita para ayudar a guiar el uso de CRISPR es una plataforma de descubrimiento que sea eficiente y pruebe cosas in silico con modelos que reconozcan genes, procesos metabólicos o vías de señalización, y que se vuelvan a entrenar y fortalecer mediante pruebas in vivo hasta el punto donde realmente pueden predecir los dos o tres cambios genómicos que proporcionarán el resultado del rasgo. Dichos modelos podrían ayudar a las empresas a tener un impacto masivo en el desarrollo y mejoramiento de los productos del mañana.

