El ingeniero en biotecnología molecular Tomás Egaña presentó la investigación con la que ha creado la primera versión de piel fotosintética, que produce y libera oxígeno, y que podrá regenerar tejido humano. Se basó en algas genéticamente modificadas que, aparte de liberar el oxígeno para la regeneración, también liberan VEGF, la proteína encargada del desarrollo de los vasos sanguíneos; y ya se piensan en otras modificaciones futuras para liberar antibióticos, anti-inflamatorios o factores de crecimiento.
En la presentación en la Universidad Católica de Chile, Egaña, doctor en Biología Humana y Farmacología, explicó que tras ocho años de análisis y pruebas con animales (ratas, cerdos y peces), iniciará el primer ensayo clínico en el Hospital del Salvador, en Santiago, con veinte pacientes que hayan sufrido traumatismos.
«Este paso, que durará seis meses, es pequeño pero muy importante para demostrar la seguridad de la tecnología. Si conseguimos que sea seguro, podremos aplicarlos en otro tipo de pacientes y enfermedades, como en trasplantes de órganos y enfermos de cáncer», afirmó Egaña.
[Recomendado: Desarrollan algas genéticamente modificadas para uso en alimentos y combustibles renovables | Algas genéticamente modificadas podrían ser clave para las celdas solares biológicas del futuro]
Esta investigación, realizada en la Universidad Católica de Chile, ha desarrollado una primera técnica para hacer un trasplante de piel a través de la implantación de unas microalgas modificadas genéticamente para producir oxígeno y así regenerar la zona.
Las algas se modificaron genéticamente para que aparte de liberar oxígeno, también liberen VEGF, la proteína encargada del desarrollo de los vasos sanguíneos; y se pueden hacer otras modificaciones futuras para liberar antibióticos, anti-inflamatorios o factores de crecimiento.
«El 90 % de las células de nuestro cuerpo no son humanas. El cuerpo humano es un verdadero ecosistema donde conviven microorganismos y células humanas. Lo que queremos averiguar es, qué ocurre en el cuerpo si implantamos microalgas que produzca la fotosíntesis», afirmó Egaña durante la presentación.
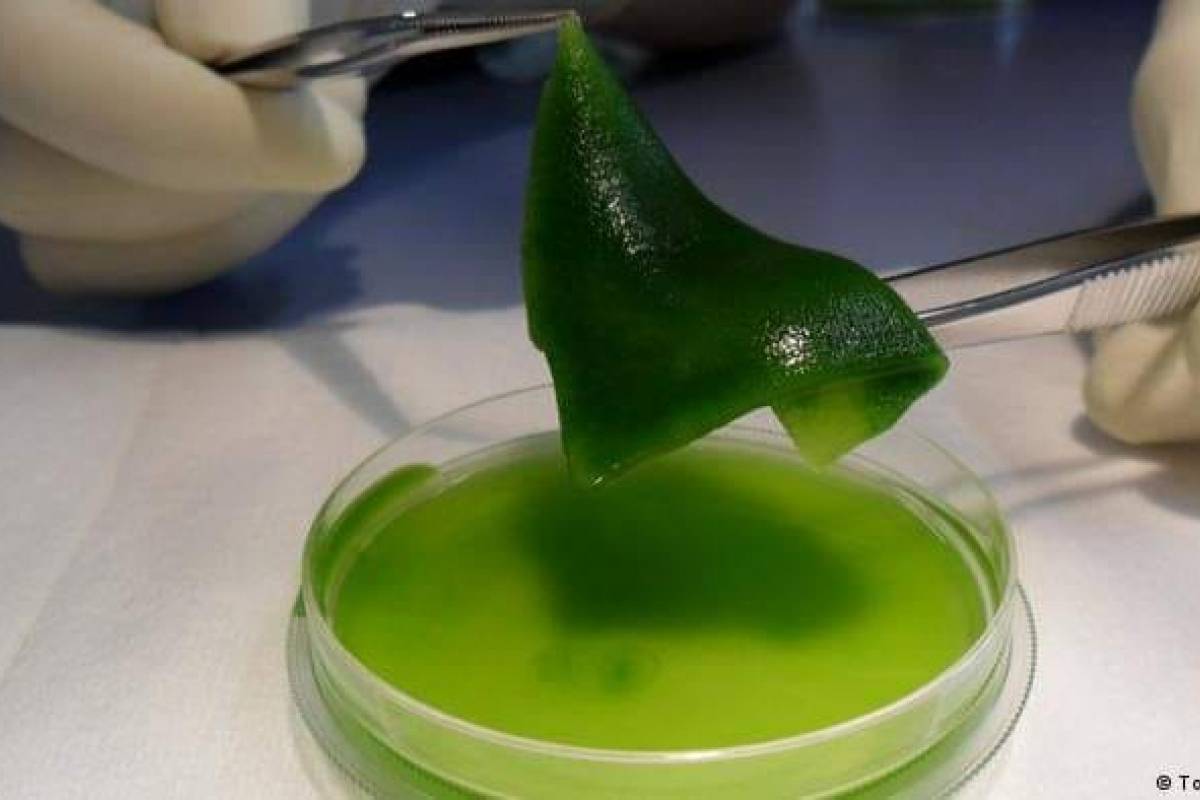
La fotosíntesis es el proceso que realizan las plantas cuando rompen las moléculas de agua, con la energía de la luz, y liberan el oxígeno que después consumen todos los seres vivos del planeta, dijo el científico chileno.
«La gran pregunta es qué podríamos lograr si los humanos consiguiéramos reproducir este proceso en un contexto terapéutico, ya que hay muchas enfermedades causadas por la falta de oxígeno como una hemorragia, un infarto, o heridas grandes que no sanan», agregó Egaña.
[Recomendado: Un alga genéticamente modificada puede salvar a los arrecifes ante el calentamiento del océano | Científicos desarrollan alga genéticamente modificada que duplica la producción de biodiesel]
La primera línea de la investigación se centra en las posibles aplicaciones de esta técnica en heridas con el fin de oxigenarlas a través de cremas, vendajes o suturas que contengan microrganimos que realicen la fotosíntesis.
Mientras que la segunda línea investiga la aplicación de esta tecnología en trasplantes de órganos, para así lograr que los órganos vivan más tiempo fuera del cuerpo, y en terapias oncológicas para conseguir una mayor eliminación de las células cancerígenas.
En el inicio de la investigación en la Universidad de Lübeck, en Alemania, donde Egaña se doctoró, se desarrolló con éxito una prueba en el que se inyectó a un embrión de pez, unas microalgas, y con éxito se fusionaron «sin que las algas mataran al embrión y sin que el embrión matara a la algas».
[Recomendado: Científicos chilenos desarrollan alga transgénica que produce fitasa para alimentación animal]
Según recalcó hoy el investigador, la clave de este primer ensayo clínico será precisamente evitar el rechazo de los pacientes a estos trasplantes.
En caso de que los veinte pacientes reciban con éxito el trasplante cutáneo, la idea es que, cuando la piel esté regenerada, el implante sea eliminado por el mismo cuerpo o retirado.
En este sentido, los próximos seis meses serán fundamentales para determinar la posible implementación que tendrá esta técnica en el futuro de la medicina.
- Fuente: https://www.efe.com/efe/america/tecnologia/cientifico-chileno-crea-piel-fotosintetica-que-podra-regenerar-tejido-humano/20000036-3814412
- Estudio: https://www.sciencedirect.com/science/article/pii/S1742706118305890?via%3Dihub
- Más información: http://www.quepasa.cl/articulo/ciencia/2016/02/el-hombre-alga.shtml/ | https://www.publimetro.cl/cl/noticias/2018/11/16/hulk-piel-regenerar-tejidos.html


