A continuación puedes revisar una completa guía sobre la cada vez más popular técnica de edición genética conocida como CRISPR.
La tecnología CRISPR es una herramienta simple pero potente para editar genomas. Permite a los investigadores alterar fácilmente las secuencias de ADN y modificar la función de los genes. Sus variadas aplicaciones potenciales incluyen la corrección de defectos genéticos, el tratamiento y la prevención de la propagación de enfermedades y la mejora de los cultivos agrícolas. Sin embargo, su promesa también plantea interrogantes éticas.
En el uso popular, «CRISPR» (que se pronuncia «crisper») es la abreviatura de «CRISPR-Cas9». CRISPRs son tramos especializados de ADN. La proteína Cas9 (o “asociada a CRISPR”) es una enzima que actúa como un par de tijeras moleculares, capaz de cortar hebras de ADN.
La tecnología CRISPR fue adaptada desde los mecanismos naturales de defensa de las bacterias y las arqueas (un dominio de microorganismos unicelulares). Estos organismos usan una molécula de ARN derivada de CRISPR y diversas proteínas Cas, incluyendo Cas9, para contrarrestar ataques de virus y otros cuerpos extraños. Lo hacen primordialmente cortando y destruyendo el ADN de un invasor foráneo. Cuando estos componentes se transfieren a otros organismos más complejos, permite la manipulación (o «edición») de sus genes.
CRISPR-Cas9: Los actores clave
* CRISPRs: «CRISPR» significa «repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas». Es una región especializada de ADN con dos características distintas: la presencia de nucleótidos se repite y espaciadores. Secuencias repetidas de nucleótidos (los bloques de construcción del ADN) se distribuyen a lo largo de una región CRISPR. Los espaciadores son fragmentos de ADN que se entremezclan entre estas secuencias repetidas.
En el caso de bacterias, los espaciadores se toman del material genético de virus que previamente atacaron el organismo. Sirven como un banco de recuerdos, que permite a las bacterias reconocer los virus y luchar contra futuros ataques.
Esto fue demostrado experimentalmente por Rodolphe Barrangou y un equipo de investigadores en Danisco, una compañía de ingredientes de alimentos. En un estudio de 2007 publicado en la revista Science, los investigadores usaron las bacterias Streptococcus thermophilus, que se encuentran comúnmente en el yogur y otros cultivos lácteos, como el alimento modelo que usaron. Observaron que después de un ataque de virus, se incorporaron nuevos espaciadores en la región CRISPR. Además, la secuencia de ADN de estos espaciadores era idéntica a partes del genoma del virus. También manipularon los espaciadores sacándolos o poniendo nuevas secuencias de ADN viral. De esta manera, fueron capaces de alterar la resistencia de las bacterias a un ataque de un virus específico. Así, los investigadores confirmaron que CRISPR desempeña un papel en la regulación de la inmunidad bacteriana.
* ARN CRISPR (ARNcr): Una vez que se incorpora un espaciador y el virus ataca de nuevo, una porción CRISPR se transcribe y procesa en ARN CRISPR, o «ARNcr». La secuencia de nucleótidos de CRISPR actúa como una plantilla para producir una secuencia complementaria de ARN monocatenaria. Cada ARNcr consiste en una repetición de nucleótidos y una porción espaciadora, de acuerdo con una revisión bibliográfica de 2014 por Jennifer Doudna y Emmanuelle Charpentier, publicada en la revista Science.
* Cas9: La proteína Cas9 es una enzima que corta ADN extraño – que no es propio del organismo.
La proteína se une típicamente a dos moléculas de ARN: ARNcr y otra denominada ARNtracr (o «ARNcr trans-activado»). Ambos ARN’s dirigen la enzima Cas9 al sitio de destino donde hará su corte. Tras el corte, la secuencia de remplazo de ADN es complementaria a un tramo de 20 nucleótidos del ARNcr.
Usando dos regiones separadas, o «dominios» en su estructura, Cas9 corta ambas cadenas de la doble hélice de ADN, haciendo lo que se conoce como una «ruptura de doble hebra», según el estudio de Science en 2014.
Hay un mecanismo de seguridad incorporado, que asegura que Cas9 no sólo corte en cualquier parte de un genoma. Las secuencias de ADN cortas conocidas como PAM («motivo adyacente de protoespaciador «) sirven como marcas y se sitúan adyacentes a la secuencia de ADN objetivo para el corte. Si el complejo Cas9 no ve un PAM junto a su secuencia de ADN objetivo, no cortará. Esta es una posible razón por la que Cas9 nunca ataca la región CRISPR en bacterias, de acuerdo con una revisión de 2014 publicada en Nature Biotechnology.
CRISPR-Cas9 como una herramienta de edición del genoma
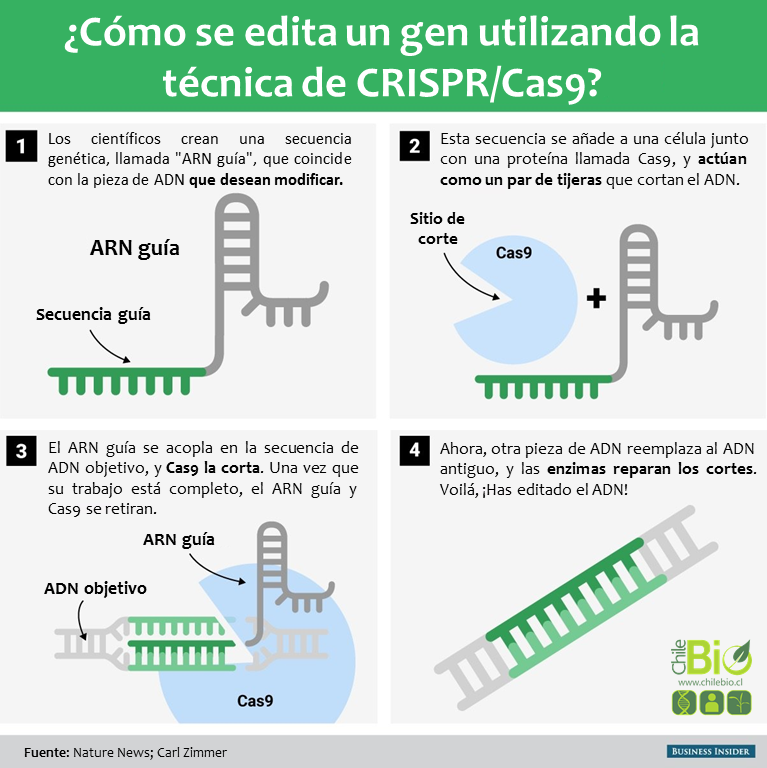
Los genomas de varios organismos codifican una serie de mensajes e instrucciones dentro de sus secuencias de ADN. La edición del genoma implica el cambio de esas secuencias, cambiando así los mensajes. Esto puede hacerse insertando un corte o ruptura en el ADN y engañando los mecanismos naturales de reparación de ADN de una célula para así introducir los cambios que uno desea. CRISPR-Cas9 proporciona un medio para hacerlo.
En 2012, se publicaron dos artículos de investigación fundamentales en las revistas Science y PNAS, que ayudaron a transformar el CRISPR-Cas9 bacteriano en una herramienta simple y programable de edición del genoma.
Los estudios, conducidos por grupos separados, concluyeron que Cas9 podría dirigirse paraa cortar cualquier región del ADN. Esto podría hacerse simplemente cambiando la secuencia de nucleótidos del ARNcr, que se une a una secuencia de ADN complementario (la secuencia objetivo para cortar). En el estudio de Science en 2012, Martin Jinek y sus colegas simplificaron aún más el sistema fusionando ARNcr y ARNtracr para crear un solo «ARN guía». Por lo tanto, la edición del genoma requiere sólo dos componentes: un ARN guía y la proteína Cas9.
«Operacionalmente, se diseña un tramo de 20 pares de bases [nucleótidos] que coinciden con un gen que se desea editar», dijo George Church, profesor de genética de la Escuela de Medicina de Harvard, Robert Winthrop. Se construye una molécula de ARN complementaria a los 20 pares de bases. Church enfatizó la importancia de asegurarse de que la secuencia de nucleótidos se encuentra sólo en el gen objetivo a cortar y en ninguna otra parte del genoma. «Entonces el ARN más la proteína [Cas9] cortará (como un par de tijeras) el ADN en ese sitio, e idealmente en ninguna otra parte,» él explicó.
Una vez que se corta el ADN, los mecanismos naturales de reparación de la célula entran en acción y trabajan para introducir mutaciones u otros cambios en el genoma. Hay dos maneras en que esto puede suceder. Según el Huntington’s Outreach Project en la Universidad de Standford, un método de reparación consiste en pegar y unir los dos cortes. Este método, conocido como «unión de extremos no-homólogos» (NHEJ), tiende a introducir errores. Los nucleótidos son accidentalmente insertados o eliminados, dando lugar a mutaciones, que podrían perturbar un gen. En el segundo método, la ruptura se fija rellenando el hueco con una secuencia de nucleótidos. Para ello, la célula utiliza una cadena corta de ADN como plantilla. Los científicos pueden suministrar la plantilla de ADN de su elección, y por lo tanto, escribir sobre cualquier gen que quieran, o corregir una mutación.
Utilidad y limitaciones
CRISPR-Cas9 se ha popularizado en los últimos años. Church señala que la tecnología es fácil de usar y es aproximadamente cuatro veces más eficiente que la mejor herramienta de edición genómica disponible antes de CRISPR, la cual se conoce como TALENs.
En 2013, los primeros informes sobre el uso de CRISPR-Cas9 para editar células humanas en un entorno experimental fueron publicados por investigadores de los laboratorios de Church y Feng Zhang del Broad Institute del Massachusetts Institute of Technology y Harvard. Los estudios que utilizan modelos in vitro (de laboratorio) y animales para enfermedades humanas han demostrado que la tecnología puede ser eficaz para corregir defectos genéticos. Ejemplos de tales enfermedades incluyen fibrosis quística, cataratas y anemia de Fanconi, según un estudio publicado en la revista Nature Biotechnology. Estos estudios allanan el camino para aplicaciones terapéuticas en seres humanos.
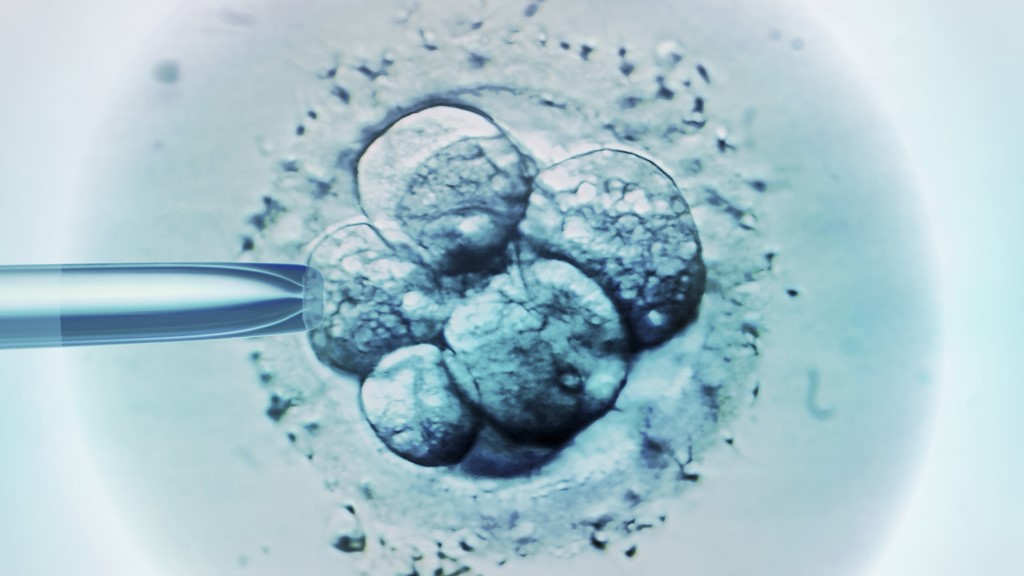
En 2015, científicos chinos editaron genéticamente embriones humanos con CRISPR para intentar corregir el gen responsable de la β-talasemia, un trastorno sanguíneo potencialmente mortal. Otro grupo chino en 2016 editaron embriones humanos dotándoles de resistencia al virus VIH.
La tecnología CRISPR también se ha aplicado en las industrias alimentaria y agrícola para modificar cultivos probióticos y para vacunar cultivos industriales (por ejemplo, el yogur) contra los virus. También se utiliza en los cultivos agrícolas para mejorar el rendimiento, resistencia a enfermedades, tolerancia a la sequía y mejorar las propiedades nutricionales.

Izquierda: Terry Huang y Chloe Gui de Aranex Biotech con plantas de maní hipoalergénico editado con CRISPR [https://goo.gl/23AlkM] | Centro: Dupont está produciendo maíz tolerante a sequía y trigo “híbrido” de mayor rendimiento con CRISPR [http://goo.gl/0fgVsV] | Derecha: Brian Staskawicz y Michael Gomez junto a plantas de yuca editadas con CRISPR para resistir el virus del estriado marrón [http://goo.gl/fU18U3].
[Artículos recomendados: Los cultivos modificados genéticamente mediante CRISPR llegarán al mercado en cinco años. | CRISPR: La técnica de edición génica que puede ayudar a alimentar al mundo.]
Otra posible aplicación es crear “gene drives”, o “genética dirigida”. Éstos son sistemas genéticos, que aumentan la probabilidad de que un rasgo en particular pase desde un progenitor a la descendencia. Eventualmente, a lo largo de las generaciones, el rasgo se propaga a través de poblaciones enteras, según el Instituto Wyss. La genética dirigida puede ayudar a controlar la propagación de enfermedades como el paludismo mediante el aumento de la esterilidad entre el vector de la enfermedad (las hembras del mosquito Anopheles gambiae) de acuerdo con un estudio de 2016 en Nature Biotechnology. Además, la genética dirigida podría también utilizarse para erradicar especies invasoras y revertir la resistencia a los pesticidas y herbicidas, según un estudio de Kenneth Oye y sus colegas, publicado en la revista Science en 2014.
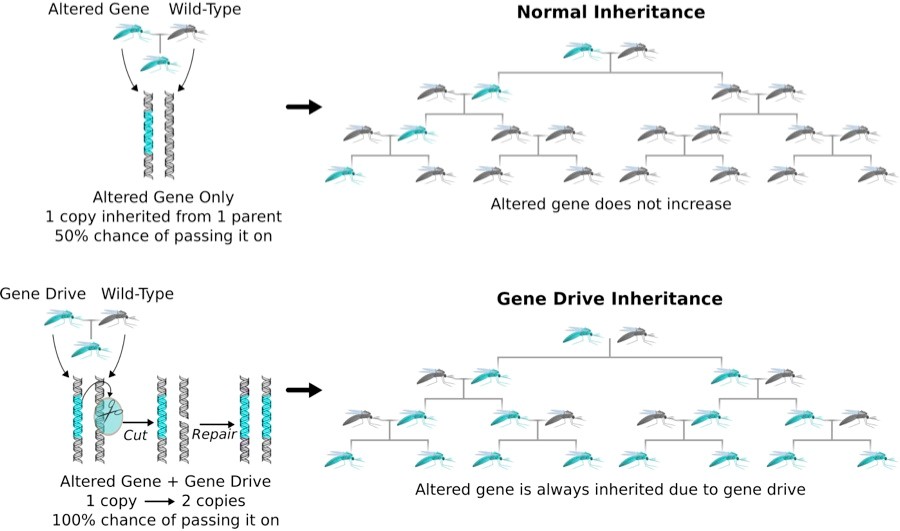
En 2015 científicos estadounidenses modificaron con CRISPR los mosquitos transmisores de la malaria para expresar el sistema “gene drive”, una especie de genes “egoístas” dominantes que se extienden rápidamente en la población. Con el control de la malaria a través de “gene drive”, ciertos genes que impiden crecer el parásito de la malaria (los mosquitos en azul), se harán más comunes y con el tiempo se extienden a toda la población. Más información: http://goo.gl/10dx5d
[Artículo recomendado: 10 formas en que la edición génica con CRISPR puede combatir la pobreza.]
Sin embargo, CRISPR/Cas9 no está exenta de inconvenientes.
«Creo que la mayor limitación de CRISPR es que no es cien por ciento eficiente», dijo Church. Además, las eficiencias de edición del genoma pueden variar. Según la revisión de 2014 publicado en Science por Doudna y Charpentier, en un estudio realizado en arroz, la edición de genes se produjo en casi el 50% de las células que recibieron el complejo ARN/Cas9. Mientras que otros análisis han demostrado que dependiendo del objetivo, las eficiencias de edición pueden alcanzar hasta 80% o más.
También existe el fenómeno de los «efectos fuera del objetivo», en los que el ADN se corta en sitios distintos de la secuencia objetivo prevista. Esto puede conducir a la introducción de mutaciones no deseadas. Además, Church señaló que incluso cuando el sistema corta la secuencia objetivo, existe la posibilidad de no obtener una edición precisa.
[Artículos recomendados: Un polémico estudio está sacudiendo las bases de la manipulación genética con CRISPR | CRISPR sobrevive a su primera gran crisis de reputación – o cómo un paper cuestionable puede hacer temblar la biotecnología actual.]
Estableciendo límites
Las numerosas aplicaciones potenciales de la tecnología CRISPR plantean interrogantes sobre los méritos éticos y las consecuencias de la manipulación de los genomas.
En el artículo de Science en 2014, Oye y sus colegas señalan el posible impacto ecológico del uso del gene drive. Un rasgo introducido podría extenderse más allá de la población objetivo a otros organismos a través de cruzamientos. El gene drive también podría reducir la diversidad genética de la población objetivo.
Hacer modificaciones genéticas a los embriones humanos y las células reproductoras como el esperma y los óvulos se conoce como edición de la línea germinal. Dado que los cambios en estas células se pueden transmitir a las generaciones posteriores, el uso de la tecnología CRISPR para hacer ediciones germinales ha planteado una serie de preocupaciones éticas.
La eficacia variable, los efectos fuera de la secuencia objetivo y las ediciones imprecisas plantean todos riesgos de seguridad que deben pasar por una evaluación. Además, hay mucho que todavía es desconocido para la comunidad científica. En un estudio publicado en Science en 2015, David Baltimore y un grupo de científicos, especialistas en ética y expertos legales señalan que la edición de la línea germinal plantea la posibilidad de consecuencias no deseadas para las futuras generaciones «porque hay límites para nuestro conocimiento de la genética humana, interacción gen-ambiente, y las vías de la enfermedad (incluyendo la interacción entre una enfermedad y otras condiciones o enfermedades en el mismo paciente)».
Otras preocupaciones éticas son más matizadas. ¿Debemos hacer cambios que podrían afectar fundamentalmente a generaciones futuras sin tener su consentimiento? ¿Qué pasa si el uso de la edición de la línea germinal cambia de ser una herramienta terapéutica a una herramienta de mejora para diversas características humanas?
Para abordar estas preocupaciones, las Academias Nacionales de Ciencias, Ingeniería y Medicina de Estados Unidos elaboraron un informe completo con directrices y recomendaciones para la edición del genoma.
Aunque las Academias Nacionales instan a la prudencia en la búsqueda de la edición de la línea germinal, enfatizan que «la precaución no significa prohibición». Recomiendan que la edición de la línea germinal sea hecha solamente en los genes que conducen a enfermedades serias y solamente cuando no hay ninguna otra alternativa razonable de tratamiento. Entre otros criterios, destacan la necesidad de disponer de datos sobre los riesgos y beneficios para la salud y la necesidad de supervisión continua durante los ensayos clínicos. También recomiendan el seguimiento de las familias para múltiples generaciones.
Entrevista al microbiólogo español Francis Mojica, uno de los precursores del desarrollo de la técnica de edición con CRISPR.